Cục Quản lý Dược khẳng định cấp phép nhập thuốc chữa ung thư đúng quy trình
Công ty Helix Pharmaceuticals Inc được cấp phép sau gần 1 năm
Ông Đỗ Văn Đông, Phó Cục trưởng Cục Quản lý Dược (Bộ Y tế) đã thừa lệnh Bộ trưởng Y tế, kí thay Cục trưởng Cục Quản lý Dược kí biên bản trả lời 11 câu hỏi của Tòa án Nhân dân Cấp cao tại TP. Hồ Chí Minh với Bộ Y tế, xung quanh các vấn đề cấp phép nhập khẩu 7 loại thuốc chữa ung thư của Công ty Helix Pharmaceuticals Inc.
 |
Trả lời câu hỏi việc cấp giấy phép hoạt động cho công ty Helix Pharmaceuticals Inc dựa vào đâu? Bộ Y tế cho biết việc cấp giấy phép hoạt động cho một công ty nước ngoài hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam được thực hiện dựa vào các căn cứ, quy định của Chính phủ, của Bộ Y tế.
Trải qua quá trình từ 2/7/2013 ( khi Cục Quản lý Dược nhận được hồ sơ cấp đề nghị cấp phép hoạt động đối với Helix Pharmaceuticals Inc) đến 18/6/2014, Cục trưởng Cục Quản lý Dược đã thừa ủy quyền Bộ trưởng công bố danh sách doanh nghiệp nước ngoài được cấp giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam đối với 63 công ty, trong đó có Helix Pharmaceutical Inc.
Sau cuộc họp của Hội đồng xét duyệt doanh nghiệp nước ngoài hoạt động về thuốc tại Việt Nam hôm 15/5/2014 với sự tham gia của 9/11 thành viên, Công ty Helix Pharmaceutical Inc cùng 62 công ty khác đã được cấp phép.
Sau khi cấp phép hoạt động cho Helix Pharmaceutical Inc, do có nghi ngờ về nguồn gốc xuất của thuốc H-Capita, Bộ Y tế đã đề nghị các cơ quan chức năng phối hợp xác minh thông tin liên quan đến thuốc H-Capita.
7 loại thuốc của Helix Pharmaceutical Inc. Canada vào Việt Nam như thế nào?
Tại phiên xử phúc thẩm vụ VN Pharma, tòa án cũng đặt câu hỏi 7 thuốc của nhà sản xuất Helix Pharmaceutical Inc. Canada được cấp phép như thế nào? Căn cứ vào đâu để rút giấy phép? Những thuốc này đã được nhập khẩu vào Việt Nam chưa? Bán ra thị trường chưa?
Theo Cục Quản lý Dược, tháng 7 - 8/2013 cơ quan này nhận hồ sơ đăng ký 07 thuốc được sản xuất bởi Helix Pharmaceutical Inc. Canada sản xuất (H2K Ciprofloxacin 200, H2K Ciprofloxacin 400, H2K Levofloxacin 250, H2K Levofloxacin 500, H2K Levofloxacin 750, H-Cipox 200, H-Levo 500) do Công ty cổ phần VN Pharma nộp.
Sau khi tiếp nhận hồ sơ, các nhóm chuyên gia thẩm định gồm 8 chuyên gia đã tiến hành thẩm định theo quy định. Nhóm thẩm định yêu cầu công ty Cổ phần VN Pharma được yêu cầu bổ sung, hoàn thiện hồ sơ đăng ký thuốc. Sau khi có hồ sơ bổ sung, các chuyên gia đã thẩm định lần 2 với 7 hồ sơ thuốc trên và khẳng định tất cả các hồ sơ được thẩm định đạt yêu cầu, đề cấp số đăng ký.
Hội đồng tư vấn cấp số đăng ký lưu hành thuốc được thành lập và họp ngày 15/5/2014 để xem xét 387 hồ sơ đăng ký thuốc (trong đó có 7 thuốc nêu trên) với sự tham gia của 11/12 thành viên Hội đồng. Kết quả đã cấp số đăng ký cho 352 thuốc, trong đó có 7 thuốc nêu trên và Cục trưởng Cục Quản lý Dược là người có trách nhiệm ký các quyết định cấp số đăng ký sau khi Hội đồng đồng ý.
Rút giấy phép lưu hành vì phát hiện bất thường
Cục Quản lý Dược cho biết, khi kiểm tra việc kê khai giá thuốc, Cục Quản lý Dược nhận thấy giá thuốc H-Capita kê khai bất thường, thấp hơn các thuốc cùng loại được sản xuất từ các nước thuộc Hệ thống hợp tác về thanh tra trong lĩnh vực thực hành tốt sản xuất thuốc (PIC/s) (Canada là một thành viên) nên đã có nghi ngờ về nguồn gốc xuất xứ của thuốc H-Capita, đã tiến hành các bước để xác minh.
Ngày 01 tháng 8 năm 2014, Cục Quản lý Dược đã có Công văn số 13134/QLD-KD yêu cầu Công ty tạm ngừng, không tiếp tục nhập khẩu và lưu hành thuốc H-Capita.
Theo kết luận của Hội đồng giám định thì hàm lượng dược chất là 97,5% (tiêu chuẩn cơ sở là từ 93% đến 105%), kết quả kiểm nghiệm tạp không định danh lớn nhất là 0,17% (tiêu chuẩn cơ sở là thấp hơn 0,1%). Như vậy, nếu đối chiếu với quy định của Luật Dược 2005 (luật chuyên ngành áp dụng tại thời điểm giám định) thì thuốc H-Capita không đạt chỉ tiêu “Tạp chất liên quan, phần tạp không định danh lớn nhất” là thuốc kém chất lượng và không được lưu hành, sử dụng.
Đồng thời Cục Quản lý Dược đã có Công văn gửi Tổng Cục An ninh II - Bộ Công An đề nghị phối hợp xác minh thông tin liên quan đến thuốc H-Capita; Liên hệ với Đại sứ quán Canada, Bộ Y tế Canada đề nghị phối hợp xác minh để làm rõ các thông tin liên quan đến các giấy tờ pháp lý của Công ty Helix Pharmaceuticals Inc, Canada; Kiểm tra đột xuất việc thực hiện quy định pháp luật về xuất nhập khẩu và kinh doanh thuốc của Công ty Cổ phần VN Pharma.
Ngày 14 tháng 8 tháng 2014, Đoàn kiểm tra đã tiến hành niêm phong toàn bộ số thuốc H-Capita (278.670 viên) có tại Công ty Cổ phần VN Pharma, lấy mẫu kiểm nghiệm.
Ngày 17 tháng 9 năm 2014, Cục Lãnh sự - Bộ Ngoại giao có Công văn số 2824/CV-LS-HPH thông báo nội dung, con dấu và người ký có tên là Tham tán Nguyễn Văn Quyền, hợp pháp hóa lãnh sự trên giấy tờ FSC, GMP, ... của thuốc H-Capita do Công ty Helix Pharmaceuticals Inc, Canada sản xuất là không đúng. Cục Quản ý Dược - Bộ Y tế đã chuyển toàn bộ thông tin cho Cục A83 - Tổng Cục An ninh II – Bộ Công An để xem xét xử lý theo thẩm quyền.
Sau đó 2 ngày, Cục Quản lý Dược đã ban hành Quyết định 522/QĐ-QLD về việc rút số đăng ký của 07 thuốc nêu trên và ngừng nhận hồ sơ, không cấp số đăng ký đối với những hồ sơ đã nộp của Công ty cổ phần VN Pharma đăng ký, Công ty Helix Pharmaceutical Inc. Canada.
Cục Quản lý Dược cho biết, theo dữ liệu của Tổng cục Hải quan và kiểm tra của Cục Quản lý Dược, chưa có lô thuốc nào của 07 thuốc trên được nhập khẩu vào Việt Nam nên cũng chưa được lưu thông trên thị trường.
Ngoài ra, Bộ Y tế cũng có trả lời các câu hỏi của tòa án liên quan đến tính thiếu thống nhất trong cách ghi tên gọi thuốc. Cụ thể đơn hàng nhập khẩu và các phần của hồ sơ ghi tên thuốc, dạng bào chế là H-Capita Caplet trong đó “H-Capita” là tên thuốc và “Caplet” hoặc “Tablet” là dạng bào chế của thuốc nên cả hai cách ghi đều đều phản ánh đúng dạng bào chế của thuốc là viên nén và không ảnh hưởng đến bản chất của thuốc hay việc sử dụng thuốc.
Còn việc 9300 hộp thuốc H-Capita thực tế nhập về như màu sắc viên, thông tin trên nhãn hộp, tá dược trên tờ hướng dẫn, thành phần tá dược, quy cách đóng gói, nhiệt độ bảo quản không thống nhất với hồ sơ đã nộp tại Cục Quản lý Dược là hành vi xảy ra sau khi cấp phép nhập khẩu nên không thuộc trách nhiệm của tổ thẩm định mà thuộc trách nhiệm của công ty nhập khẩu...
Tin mới hơn

Bộ Y tế chỉ đạo khẩn sau ca mắc cúm gia cầm A(H9) trên người đầu tiên

Bộ Y tế yêu cầu tăng cường kiểm tra, giám sát kê đơn thuốc
Ngày Thầy thuốc Việt Nam 27/2: Ra mắt cuốn sách "Bản lĩnh blouse trắng"

Sau Tết, tiếp tục giám sát chặt các dịch bệnh
Bé gái 5 tuổi bị mất một bàn tay vì hàng xóm đốt pháo
Tin bài khác
Phẫu thuật loại bỏ khối u "khổng lồ" cho cụ bà gần 90 tuổi
Phối hợp nhiều chuyên khoa cứu sống một phụ nữ bị đâm 17 vết dao

TP Hồ Chí Minh: Em bé đầu tiên được thông tim trong bào thai chào đời khỏe mạnh

Cô gái hôn mê sau phẫu thuật thẩm mỹ đặt túi ngực, hạ gò má

Dập nát bàn tay do nổ pháo tự chế
Đọc nhiều

Cách dịch biển số xe xấu-đẹp tại Việt Nam

Tự soi mình theo Nghị quyết Trung ương 4 để liên hệ, kiểm điểm, khắc phục
![[Megastory] Phát hiện 11 ca nhiễm COVID-19, Thái Nguyên nâng cao các giải pháp ứng phó](https://thainguyentv.vn/stores/news_dataimages/phanletung/112021/02/10/medium/2612_d49d1cca37d4ff8aa6c5.jpg?rt=20211102102614?211102104719)
[Megastory] Phát hiện 11 ca nhiễm COVID-19, Thái Nguyên nâng cao các giải pháp ứng phó

Khu cách ly tập trung đầu tiên trên địa bàn tỉnh Thái Nguyên sẵn sàng hoạt động
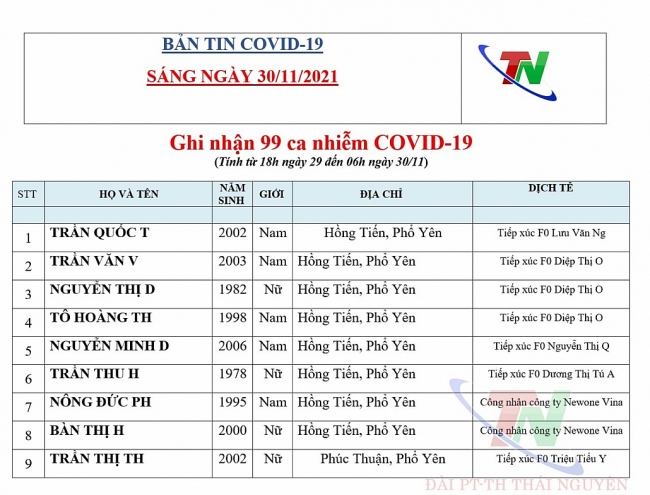
Thái Nguyên: 99 ca nghi nhiễm Covid-19, ghi nhận 57 ca mắc Covid-19 (ngày 30/11)
Multimedia
![[Infographics] Phương án sắp xếp, tinh gọn tổ chức bộ máy của hệ thống chính trị tỉnh Thái Nguyên](https://thainguyentv.vn/stores/news_dataimages/2024/122024/19/11/croped/medium/ban-chot-0120241219115710.webp?rt=202412281405?241219035125)
[Infographics] Phương án sắp xếp, tinh gọn tổ chức bộ máy của hệ thống chính trị tỉnh Thái Nguyên
![[Megastory] Thái Nguyên: Triển vọng từ mô hình chăn nuôi lợn lấy thịt từ thức ăn tự nhiên có bổ sung nguyên liệu chè xanh](https://thainguyentv.vn/stores/news_dataimages/2024/112024/09/14/croped/medium/120241109142849.webp?rt=202412281405?241109104920)
[Megastory] Thái Nguyên: Triển vọng từ mô hình chăn nuôi lợn lấy thịt từ thức ăn tự nhiên có bổ sung nguyên liệu chè xanh
![[Megastory] Ký ức Lễ trình quốc thư đầu tiên](https://thainguyentv.vn/stores/news_dataimages/2024/102024/10/08/croped/medium/megastory-ky-uc-le-trinh-quoc-thu-dau-tien-20241010084511.webp?rt=202412281405?241010084837)
[Megastory] Ký ức Lễ trình quốc thư đầu tiên
![[Infographic] Nhìn lại công tác ứng phó, khắc phục thiệt hại do bão số 3 và mưa lũ sau bão gây ra trên địa bàn tỉnh Thái Nguyên](https://thainguyentv.vn/stores/news_dataimages/2024/102024/08/20/croped/medium/z5909855142124-fb27c24c481acb5d3d89295e079683e920241008202613.webp?rt=202412281405?241009090909)
[Infographic] Nhìn lại công tác ứng phó, khắc phục thiệt hại do bão số 3 và mưa lũ sau bão gây ra trên địa bàn tỉnh Thái Nguyên
![[Infographic] Kết quả phát triển kinh tế - xã hội tỉnh Thái Nguyên 9 tháng năm 2024](https://thainguyentv.vn/stores/news_dataimages/2024/102024/07/22/croped/medium/infor-kinh-te-xa-hoi-0120241007223357.webp?rt=202412281405?241008110930)
[Infographic] Kết quả phát triển kinh tế - xã hội tỉnh Thái Nguyên 9 tháng năm 2024
![[Photo] Mùa lúa ở Bản Tèn](https://thainguyentv.vn/stores/news_dataimages/2024/102024/08/10/croped/medium/dji-037520241008104229.webp?rt=202412281405?241008094605)
[Photo] Mùa lúa ở Bản Tèn